CRISPR – Tijdens haar lezing over de Nobelprijs voor de Scheikunde in 2018 zei Frances Arnold: “Tegenwoordig kunnen we voor alle praktische doeleinden elke DNA-reeks lezen, schrijven en bewerken, maar we kunnen deze niet samenstellen.” Dat is niet meer waar.
CRISPR Sindsdien zijn wetenschap en technologie zo vooruitgegaan dat kunstmatige intelligentie heeft geleerd DNA samen te stellen, en met genetisch gemodificeerde bacteriën zijn wetenschappers op weg om op maat gemaakte eiwitten te ontwerpen en te maken.
Het doel is dat wetenschappers, met de ontwerptalenten van AI en de technische vaardigheden van genbewerking, bacteriën kunnen modificeren om te fungeren als minifabrieken die nieuwe eiwitten produceren die broeikasgassen kunnen verminderen, plastics kunnen verteren of kunnen fungeren als soortspecifieke pesticiden.
Als scheikundeprofessor en computationeel scheikundige die moleculaire wetenschappen en milieuchemie bestudeert, geloof ik dat de vooruitgang op het gebied van AI en genbewerking dit een realistische mogelijkheid maakt.
Gensequencing – het lezen van de recepten van het leven
Alle levende wezens bevatten genetische materialen – DNA en RNA – die de erfelijke informatie verschaffen die nodig is om zichzelf te vermenigvuldigen en eiwitten te maken. Eiwitten vormen 75% van het droge gewicht van de mens. Ze vormen spieren, enzymen, hormonen, bloed, haar en kraakbeen. Het begrijpen van eiwitten betekent dat je een groot deel van de biologie begrijpt. De volgorde van nucleotidebasen in DNA, of RNA in sommige virussen, codeert voor deze informatie, en technologieën voor genomische sequencing identificeren de volgorde van deze basen.
Het Human Genome Project was een internationale inspanning die van 1990 tot 2003 het volledige menselijke genoom in kaart bracht. Dankzij snel verbeterende technologieën duurde het zeven jaar om de eerste 1% van het genoom te sequencen en nog eens zeven jaar voor de resterende 99%. In 2003 beschikten wetenschappers over de volledige sequentie van de 3 miljard nucleotidebasenparen die codeerden voor 20.000 tot 25.000 genen in het menselijk genoom.
Het begrijpen van de functies van de meeste eiwitten en het corrigeren van hun storingen bleef echter een uitdaging.
AI leert eiwitten
De vorm van elk eiwit is cruciaal voor zijn functie en wordt bepaald door de volgorde van zijn aminozuren, die op zijn beurt wordt bepaald door de nucleotidesequentie van het gen. Verkeerd gevouwen eiwitten hebben de verkeerde vorm en kunnen ziekten veroorzaken zoals neurodegeneratieve ziekten, cystische fibrose en diabetes type 2. Om deze ziekten te begrijpen en behandelingen te ontwikkelen, is kennis van eiwitvormen vereist.
Vóór 2016 was de enige manier om de vorm van een eiwit te bepalen via röntgenkristallografie , een laboratoriumtechniek die gebruik maakt van de diffractie van röntgenstralen door enkele kristallen om de precieze rangschikking van atomen en moleculen in drie dimensies in een molecuul te bepalen. Destijds was de structuur van ongeveer 200.000 eiwitten bepaald door kristallografie, wat miljarden dollars kostte.
AlphaFold, een machine learning-programma , gebruikte deze kristalstructuren als trainingsset om de vorm van de eiwitten te bepalen op basis van hun nucleotidesequenties. En in minder dan een jaar tijd berekende het programma de eiwitstructuren van alle 214 miljoen genen waarvan de sequentie was bepaald en gepubliceerd. De door AlphaFold bepaalde eiwitstructuren zijn allemaal vrijgegeven in een vrij beschikbare database .
Om niet-infectieuze ziekten effectief aan te pakken en nieuwe medicijnen te ontwerpen, hebben wetenschappers meer gedetailleerde kennis nodig van hoe eiwitten, vooral enzymen, kleine moleculen binden. Enzymen zijn eiwitkatalysatoren die biochemische reacties mogelijk maken en reguleren.
Ook wij hebben jou steun nodig in 2025, gun ons een extra bakkie koffie groot of klein.
Dank je en proost?
Wij van Indignatie AI zijn je eeuwig dankbaar
AlphaFold3 , uitgebracht op 8 mei 2024, kan eiwitvormen voorspellen en de locaties waar kleine moleculen zich aan deze eiwitten kunnen binden. Bij rationeel geneesmiddelenontwerp worden geneesmiddelen ontworpen om eiwitten te binden die betrokken zijn bij een route die verband houdt met de te behandelen ziekte. De kleine molecuulgeneesmiddelen binden zich aan de eiwitbindingsplaats en moduleren de activiteit ervan, waardoor het ziektepad wordt beïnvloed. Door eiwitbindingsplaatsen te kunnen voorspellen, zal AlphaFold3 de mogelijkheden voor geneesmiddelenontwikkeling van onderzoekers vergroten.
AI + CRISPR = nieuwe eiwitten samenstellen
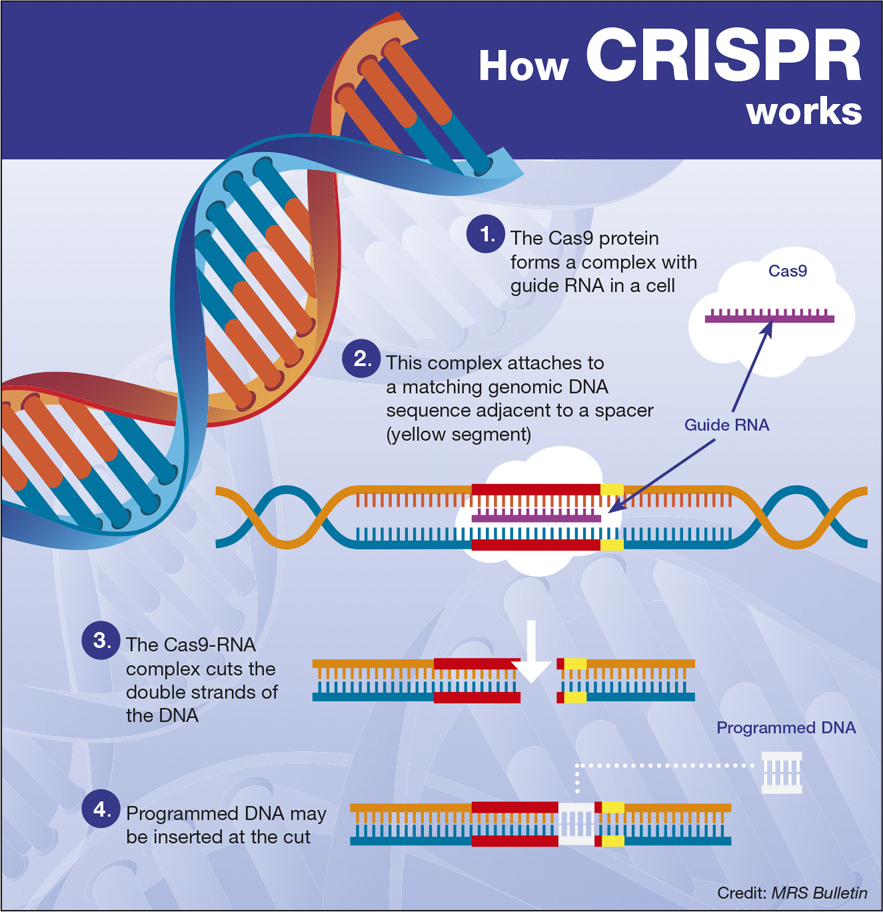
Rond 2015 zorgde de ontwikkeling van CRISPR-technologie voor een revolutie in het bewerken van genen. CRISPR kan worden gebruikt om een specifiek deel van een gen te vinden, het te veranderen of te verwijderen, de cel meer of minder van zijn genproduct te laten uitdrukken, of zelfs een volkomen vreemd gen in de plaats te voegen.
In 2020 ontvingen Jennifer Doudna en Emmanuelle Charpentier de Nobelprijs voor de scheikunde “ voor de ontwikkeling van een methode (CRISPR) voor genoombewerking .” Met CRISPR kan het bewerken van genen, dat ooit jaren in beslag nam en soortspecifiek, kostbaar en arbeidsintensief was, nu in enkele dagen en tegen een fractie van de kosten worden uitgevoerd.
AI en genetische manipulatie ontwikkelen zich snel. Wat ooit ingewikkeld en duur was, is nu routine. Vooruitkijkend is de droom van op maat gemaakte eiwitten die zijn ontworpen en geproduceerd door een combinatie van machinaal leren en CRISPR-gemodificeerde bacteriën. AI zou de eiwitten ontwerpen, en bacteriën die met behulp van CRISPR waren veranderd, zouden de eiwitten produceren. Enzymen die op deze manier worden geproduceerd, kunnen mogelijk kooldioxide en methaan inademen terwijl ze organische grondstoffen uitademen, of plastics afbreken tot vervangers van beton.
Ik geloof dat deze ambities niet onrealistisch zijn, gezien het feit dat genetisch gemodificeerde organismen al 2% van de Amerikaanse economie in de landbouw en farmaceutische sector voor hun rekening nemen.
Twee groepen hebben vanaf het begin functionerende enzymen gemaakt die zijn ontworpen door verschillende AI-systemen. Het Institute for Protein Design van David Baker aan de Universiteit van Washington bedacht een nieuwe op deep learning gebaseerde eiwitontwerpstrategie, genaamd ‘ familiebrede hallucinatie ’, die ze gebruikten om een uniek lichtgevend enzym te maken . Ondertussen heeft biotech-startup Profluent een AI gebruikt die is getraind op basis van de som van alle CRISPR-Cas-kennis om nieuwe functionerende genoomeditors te ontwerpen .
Als AI kan leren nieuwe CRISPR-systemen te maken, evenals bioluminescente enzymen die werken en nog nooit op aarde zijn gezien, is er hoop dat de combinatie van CRISPR met AI kan worden gebruikt om andere nieuwe op maat gemaakte enzymen te ontwerpen. Hoewel de CRISPR-AI-combinatie nog in de kinderschoenen staat, zal deze, zodra deze volwassen is geworden, waarschijnlijk zeer nuttig zijn en zelfs de wereld kunnen helpen de klimaatverandering aan te pakken.
Het is echter belangrijk om te onthouden dat hoe krachtiger een technologie is, hoe groter de risico’s zijn die deze met zich meebrengt. Bovendien zijn mensen niet erg succesvol geweest in het manipuleren van de natuur vanwege de complexiteit en onderlinge verbondenheid van natuurlijke systemen, wat vaak tot onbedoelde gevolgen leidt.







