
Voor het eerst in de Verenigde Staten is een genbewerkingstool gebruikt om gevorderde kanker bij drie patiënten te behandelen en dit liet veelbelovende vroege resultaten zien in een pilot-fase 1 klinische studie . Tot nu toe lijkt de behandeling veilig en worden er binnenkort meer resultaten verwacht.
Om een veiligere en effectievere behandeling voor kankerpatiënten te ontwikkelen, ontwikkelden wetenschappers van de Universiteit van Pennsylvania , het Parker Institute for Cancer Immunotherapy in San Francisco en Tmunity Therapeutics , een biotechbedrijf in Philadelphia, een geavanceerde versie van immunotherapie. Bij deze behandeling worden de eigen immuuncellen van een patiënt uit het lichaam verwijderd, getraind om specifieke kankercellen te herkennen en vervolgens terug in de patiënt geïnjecteerd waar ze zich vermenigvuldigen en vernietigen.
In tegenstelling tot chemotherapie of bestralingstherapie, die direct kankercellen doodt, activeert immunotherapie het eigen immuunsysteem van het lichaam om het werk te doen. Dit team gebruikte een genbewerkingstool genaamd CRISPR om immuuncellen te veranderen, waardoor ze getrainde soldaten werden om kankercellen te lokaliseren en te doden. Door deze techniek te gebruiken, hoopte het team een effectievere vorm van immunotherapie te ontwikkelen met minimale bijwerkingen.
Ik ben opgeleid als farmaceutisch wetenschapper en biomoleculair ingenieur, en ik was vooral geïnteresseerd in deze nieuwe therapie omdat mijn laboratorium zich richt op het bewerken van de gen-editors. Ik probeer in het bijzonder nog betere CRISPR-gebaseerde gen-editors te ontwikkelen voor de diagnose en behandeling van kanker en andere aandoeningen. We combineren chemie, biologie en nanotechnologie om tools voor het bewerken van genen efficiënter en nauwkeuriger te ontwikkelen, beheren en leveren.
Trainen van de immuuncellen om kanker te vinden en te doden
De eerste stap bij het maken van deze tumor-dodende cellen die in de kankertest werd gebruikt, was het isoleren van de T-cellen – een soort witte bloedcellen die ziekteverwekkers en kankercellen bestrijdt – uit het bloed van de kankerpatiënten. Twee patiënten met gevorderd multipel myeloom en een patiënt met myxoïde / ronde celliposarcoom namen deel aan deze studie.
Om de T-cellen te bewapenen en hun tumorbestrijdende vaardigheden te versterken zonder normale cellen te beschadigen, hebben wetenschappers de T-cellen genetisch gemanipuleerd – drie genen uitgeschakeld en één gen toegevoegd – voordat ze aan de patiënten werden teruggegeven.
Ook wij hebben jou steun nodig in 2025, gun ons een extra bakkie koffie groot of klein.
Dank je en proost?
Wij van Indignatie AI zijn je eeuwig dankbaar
De eerste twee van deze verwijderde genen coderen voor T-celreceptoren, dit zijn eiwitten die worden gevonden op het oppervlak van de T-cellen die specifieke moleculen, bekend als antigenen, op kankercellen kunnen herkennen en binden. Wanneer deze gemanipuleerde T-cellen aan deze antigenen binden, kunnen ze de kankercellen aanvallen en direct doden. Maar het probleem is dat een enkele T-cel meerdere verschillende antigenen in het lichaam kan herkennen, waardoor ze minder gefocust zijn op het vinden van de kankercellen. Door deze twee genen te elimineren, vallen de T-cellen minder snel het verkeerde doelwit of de gastheer aan, een fenomeen dat auto-immuniteit wordt genoemd,
Bovendien verstoorden ze een derde gen, het zogenaamde celdoodeiwit 1, dat de immuunrespons vertraagt. Het uitschakelen van het geprogrammeerde celdood-eiwit 1-gen verbetert de efficiëntie van T-cellen.
De laatste stap in de transformatie van deze cellen was het toevoegen van een gen dat een nieuwe T-celreceptor produceert die een specifieke marker op de kankercellen herkent en NY-ESO-1 genoemd. Met drie genen verwijderd en één toegevoegd, zijn de T-cellen nu klaar om kanker te bestrijden.
Waar is CRISPR in deze klinische proef?
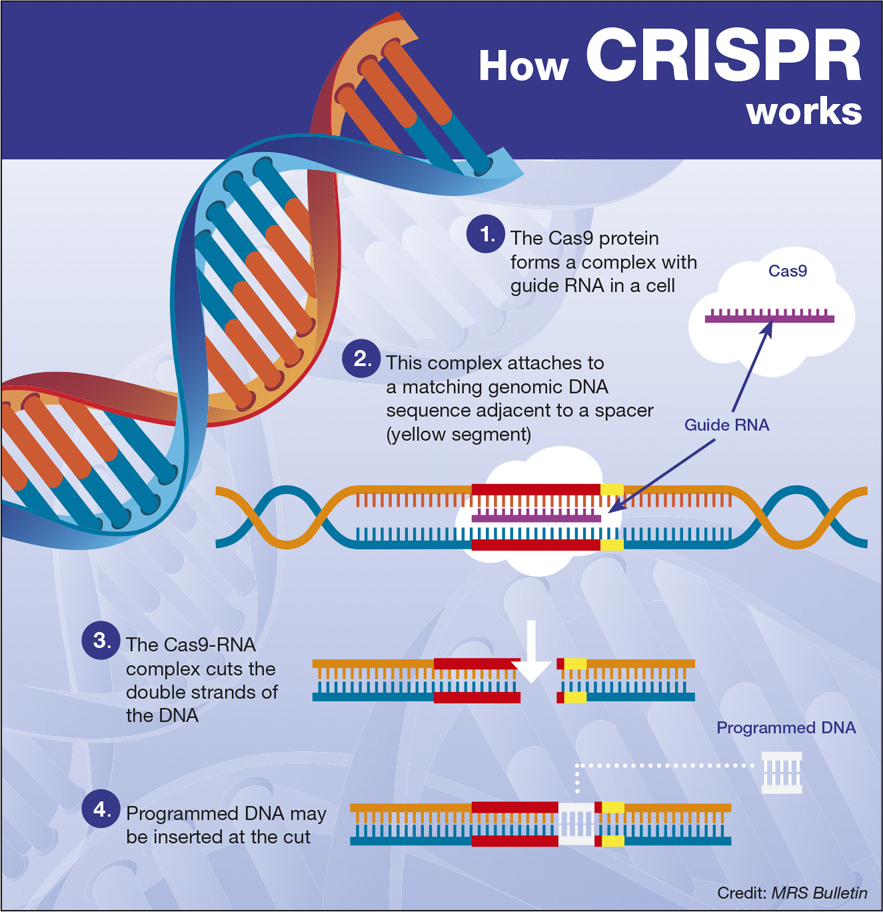
Dus hoe precies heeft dit team een T-cel bewerkt? Ze maakten gebruik van CRISPR / Cas9-genbewerkingstechnologie die twee componenten gebruikt: een gids-CRISPR-molecuul dat de doelgenplaats vindt en bindt; en een moleculaire schaar, Cas9, die het DNA knipt, waardoor het gen uiteindelijk wordt uitgeschakeld.
Het team gebruikte elektroporatie, een technologie die tijdelijke gaten in het celmembraan creëert, om het Cas9-eiwit af te leveren samen met de gidsmoleculen die gericht waren op de drie genen van belang in miljoenen T-cellen.
Na het verstoren van de drie genen met CRISPR, gebruikte het team een veilig, gedeactiveerd virus om een gen aan de T-cel af te geven dat het in staat zou stellen de kankerspecifieke marker te herkennen – NY-ESO-1. Het verwijderen van deze genen uit miljoenen cellen en vervolgens toestaan dat de T-cellen zich vermenigvuldigen tot miljarden cellen buiten het lichaam in petrischalen, kan enkele dagen tot weken duren.
Vier dagen voordat de CRISPR-gemodificeerde T-cellen werden geïnjecteerd, gaf het team elk van de drie patiënten verschillende doses chemotherapie om de bestaande witte bloedcellen in hun lichaam uit te putten.
Ten slotte werden ongeveer 100 miljoen gemodificeerde T-cellen per kilogram lichaamsgewicht geïnjecteerd in de patiënten als een enkele infusie.

Veelbelovende toekomst van CRISPR
Het team volgde de patiënten continu gedurende de eerste 28 dagen na injectie van de T-cellen. Daarna volgden ze maandelijks zes maanden op; daarna om de drie maanden door bijwerkingen zoals immuunreactie te volgen. De T-celtherapie wordt vaak geassocieerd met verschillende bijwerkingen zoals koorts, spierpijn, hoofdpijn, verwardheid, epileptische aanvallen, lage bloeddruk, bloedingsstoornissen en meervoudige orgaandisfunctie. Het team constateerde bij geen enkele patiënt tekenen van toxiciteit, wat opwindend is.
Maar de eerste patiënt met gevorderd multipel myeloom had na 60 dagen de groei van een tumor voortgezet. Hoewel de behandeling niet zo succesvol leek voor de eerste patiënt, is de fase 1 klinische studie vooral bedoeld om de veiligheid te testen, en het team meldde geen toxiciteit voor een patiënt.
De tweede patiënt met geavanceerde myxoïde / ronde cel liposarcoom werd gevolgd met behulp van seriële CT-scans en leek stabiel na 90 dagen. De derde patiënt met multipel myeloom is onlangs aan het onderzoek begonnen en is te vroeg voor enig resultaat. Het feit dat er geen ernstige toxiciteitsproblemen waren met deze nieuwe therapie waarbij de CRISPR-gebaseerde genbewerkingstechnologie bij kankerpatiënten betrokken is, is een opmerkelijke stap in de richting van een breed gebruik in de kliniek.







