
Door ernstige schendingen en manipulaties van het onderzoeksprotocol slaagde één van de grootste farmaceuten ter wereld – Pfizer – erin om de noodtoestemming van de FDA voor het covid-19 vaccin voor kinderen te verkrijgen.
Analyse en vergelijking van het door Pfizer aan de Amerikaanse Food and Drug Administration (FDA) voorgelegd beoordelingsdocument, op basis waarvan de FDA groen licht heeft gegeven om de noodvergunning voor covid-vaccinatie ook voor kinderen van 12-15 jaar uit te breiden – in tegenstelling tot het onderzoeksprotocol bij kinderen – onthullen zorgwekkende bevindingen, waaronder schendingen van het protocol dat door Pfizer zèlf is opgesteld. En niet minder ernstig het ontwerp van het onderzoeksprotocol op een manier die het bedrijf in staat stelt om als positieve bevindingen te presenteren in termen van vaccinveiligheid bij kinderen, èn om zo min mogelijk ernstige bijwerkingen op te nemen in de beoordeling die aan de FDA werd voorgelegd.
1. Overtreding van protocolvoorwaarden – Hoe werden kinderen met een psychiatrische diagnose opgenomen in het onderzoek?
Volgens het beoordelingsdocument dat door Pfizer bij de FDA is ingediend, leden vier van de 1131 kinderen in de onderzoeksgroep die het Pfizer-BioNTech COVID-19-vaccin toegediend kregen aan ernstige ongewenste voorvallen (“serious adverse events – SAE’s”) – dat wil zeggen, voorvallen waarbij ten minste aan één criterium is voldaan:
– veroorzaakt de dood,
– is levensbedreigend,
– vereist ziekenhuisopname of verlenging van bestaande ziekenhuisopname,
– resulteert in blijvende invaliditeit/ongeschiktheid,
– een aangeboren afwijking/geboorteafwijking.
Van deze vier kinderen hadden er drie zo’n ernstige depressie dat ze kort na vaccinatie in het ziekenhuis werden opgenomen (respectievelijk in de eerste 7 dagen na de eerste dosis, bij de tweede slechts één dag na de tweede dosis en in de derde 15 dagen na de eerste dosis).

De consequentie van deze bevinding is buitengewoon verontrustend, aangezien het betekent dat één op de 350-400 kinderen die gevaccineerd worden, aan een ernstige depressie kan lijden en in het ziekenhuis moet worden opgenomen.
Om het grote publiek gerust te stellen merkt Pfizer in zijn beoordelingsdocument op dat in feite alle drie de kinderen een reeds bestaande diagnose van angst en depressie hadden. Bovendien (leggen ze uit) werd over alle drie feitelijk een selectieve serotonineheropnameremmer (SSRI) gemeld die begon binnen 1-2 maanden voorafgaand aan vaccinatie.
“Verergering van suïcidale ideeën met initiële SSRI-behandeling bij adolescenten”, legt Pfizer uit, “is een erkend risico en biedt een redelijke alternatieve verklaring voor verergering van depressie bij deze BNT162b2-ontvangers”. De eerste genetisch bepaalde reactie van een farmaceut: waarom het vaccin de schuld geven, als er een volkomen redelijke en logische alternatieve verklaring is voor de verergering van hun depressie?
Wat valt er op te merken over de uitleg van de fabrikant?
Twee problemen:
a. De bewering dat de SSRI’s die de kinderen hebben gekregen een alternatieve verklaring zijn voor de verslechtering van de mentale toestand van de kinderen is twijfelachtig. Volgens de wetenschappelijke literatuur treedt verergering van zelfmoord en mentale toestand op direct aan het begin van de behandeling met antidepressiva, meestal in de eerste twee weken, en zeker niet meer dan een maand na het starten van de behandeling – dat is het moment waarop men verbetering begint te zien. In feite is het tegenovergestelde waar: als er binnen vier weken geen verbetering is, wordt een medicijn meestal vervangen.
b. Belangrijker is dat volgens het onderzoeksprotocol deelnemers met een eerdere psychiatrische diagnose nóóit in het onderzoek hadden mogen worden opgenomen (pagina 41 in het protocol).
Het blijkt dat een van de uitsluitingscriteria in het onderzoek is: “Andere medische of psychiatrische aandoening, waaronder recente (in het afgelopen jaar) of actieve zelfmoordgedachten/gedrag of laboratoriumafwijkingen die het risico op deelname aan het onderzoek kunnen verhogen of, in het oordeel, de deelnemer ongeschikt maken voor het onderzoek”.

Dit is dan ook een flagrante schending van het door het bedrijf zelf opgestelde en door de FDA goedgekeurde studieprotocol. De implicatie van een dergelijke schending is ernstig: als Pfizer zo nalatig zou zijn geweest dat ze proefpersonen met een psychiatrische achtergrond in het experiment hebben opgenomen – in tegenstelling tot het protocol dat ze zelf hebben opgesteld – betekent dit dat het welzijn van de proefpersonen niet hun grootste zorg is. Zoals Pfizer zelf in het protocol opmerkt: een dergelijke achtergrond kan het risico op deelname aan het onderzoek vergroten. En als ze zich niet houden aan ethiek bij het werven van proefpersonen, wie kan ons dan verzekeren dat ze zich houden aan ethiek in andere delen van het onderzoek – bijvoorbeeld analyse van resultaten?
2. Ontwerp het protocol zodanig dat het bedrijf positieve bevindingen kan presenteren met betrekking tot de veiligheid van het vaccin.
Ook wij hebben jou steun nodig in 2025, gun ons een extra bakkie koffie groot of klein.
Dank je en proost?
Wij van Indignatie AI zijn je eeuwig dankbaar
In ten minste twee criteria lijkt het bedrijf het protocol zó manipulatief te hebben ontworpen dat het in staat zou zijn om zo positief mogelijke bevindingen te presenteren in termen van vaccinveiligheid bij kinderen:
a. Het protocol zó ontwerpen dat de opname van ernstige ongewenste voorvallen in een aan de FDA ingediend rapport zoveel mogelijk wordt verminderd.
In het Pediatric Study Protocol (zie tabel) beloofde Pfizer dat de duur van de follow-up voor ernstige ongewenste voorvallen (SAE’s) “van dosis 1 tot 6 maanden na de tweede dosis” zou zijn.
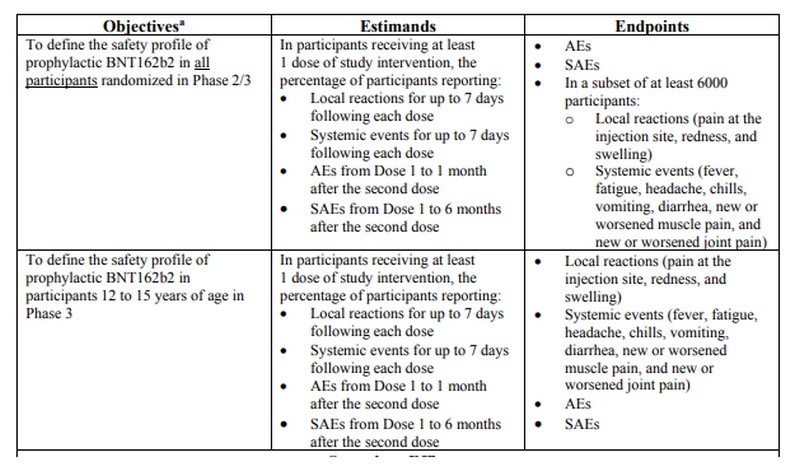
Een follow-upperiode van zes maanden wordt als zeer kort beschouwd in vergelijking met de gebruikelijke follow-uptijd in fase 3-onderzoeken voor vaccins. Volgens de FDA zou fase 3 in vaccinonderzoeken tussen één en vier jaar moeten duren.
Toch blijkt uit het beoordelingsdocument van Pfizer dat het bedrijf zelfs deze relatief korte follow-upperiode niet heeft voltooid, en in feite tevreden was met slechts 30 dagen follow-up van de ernstige bijwerkingen. Dit feit blijkt uit het hoofdstuk over de datum van analyse (pagina 30, onder de kop van het hoofdstuk SAE’s): “12-15-jarigen: SAE’s van dosis 1 tot maximaal 30 dagen na dosis 2 in lopende follow- up werden gemeld door 0,4% van de BNT162b2-ontvangers en 0,1% van de placebo-ontvangers“.

Hoe is dit mogelijk gemaakt?
Op pagina 114 van het onderzoeksprotocol – in het hoofdstuk over het tijdstip waarop de statistische analyses zullen worden uitgevoerd – heeft Pfizer een aantal tijdstippen vastgesteld voor het uitvoeren van deze analyses. Terwijl de maximale tijdsperiode voor het monitoren van ernstige bijwerkingen in de algemene onderzoekspopulatie zes maanden is (de zevende sectie), stelde de vijfde sectie een extra afkappunt vast, van slechts 30 dagen na de tweede dosis, met het oog op het vergelijken van gegevens tussen twee leeftijdsgroepen: een van 12-15 jaar en een van 16-25 jaar.

Met andere woorden, het protocol lijkt zó te zijn opgezet dat in de review die aan de FDA wordt voorgelegd, alleen de ernstige bijwerkingen worden meegenomen die zich in de eerste maand na vaccinatie hebben voorgedaan.
De follow-up van de ernstige bijwerkingen duurt inderdaad nog vijf maanden, maar elke bijwerking die tijdens deze maanden werd ontdekt, of een bijwerking die tijdens de eerste maand werd waargenomen maar als niet-ernstig werd gedefinieerd en verergerde gedurende de volgende maanden (anders verandert de diagnose) – verschijnen gewoon niet in het beoordelingsrapport.
De zorgwekkende implicatie van deze praktijk is dat ernstige ongewenste voorvallen mogelijk niet voorkomen in het rapport op basis waarvan de FDA de noodtoelating voor kinderen afgeeft, dus voortgezette follow-up, zelfs indien gepubliceerd enkele maanden of jaren nadat de tijdelijke autorisatie was verleend, zal geen kinderen helpen die schade zullen oplopen of sterven na het groene licht afgegeven door de FDA.
b Het protocol zó ontwerpen dat diagnoses van ernstige ongewenste voorvallen die hebben plaatsgevonden in ziekenhuizen die geen verband houden met de onderzoekslocatie kunnen worden genegeerd.
Binnen de voorwaarden van de Outcome Measures in het onderzoeksprotocol, zoals weergegeven in Clinicaltrials.gov, heeft Pfizer bepaald dat het door Pfizer geselecteerde onderzoeksteam degenen zal zijn die de bijwerkingen als zodanig definiëren: “Zoals aan het licht gebracht door personeel van de onderzoekslocatie”. Op deze manier heeft het bedrijf de door hen geselecteerde onderzoekers in feite de bevoegdheid gegeven om zelf te bepalen wat de diagnose zal zijn, ongeacht de diagnose die wordt gesteld in het ziekenhuis/de afdeling die niet is gedefinieerd als de onderzoekslocatie.
Waarom dit problematisch is?
Omdat een dergelijke vaststelling betekent dat als een bepaalde deelnemer ernstige bijwerkingen heeft en bijvoorbeeld buiten het ziekenhuis of de afdeling die als onderzoekslocatie fungeert, is behandeld, in feite de diagnose die door de behandelend artsen van het ziekenhuis/ afdeling waar de deelnemer wordt behandeld, niet relevant geacht wordt. Op deze manier heeft Pfizer zijn team daadwerkelijk in staat gesteld om te bepalen wat de diagnose zal zijn, in plaats van zich door de diagnose van de behandelende artsen te laten verwarren.
Afgezien van de ernstige kritiek op Pfizer, roepen de analyse en vergelijking ernstige vragen op voor de FDA zelf:
* Hoe is het mogelijk dat de FDA zelfs een protocol heeft goedgekeurd dat dergelijke manipulaties toestaat?
* Waarom heeft de FDA het bedrijf toegestaan om de data-analyse uit te voeren en de aanvraag voor de noodvergunning bij kinderen in te dienen na zo’n korte follow-up tijd van slechts 30 dagen?
* Wat maakte de FDA zo enthousiast om de noodvergunning voor kinderen goed te keuren? Waarom wordt deze goedkeuring gegeven op basis van een veiligheidsrapport dat nog niet eens halverwege “klaar is”? Er ìs immers geen noodsituatie voor kinderen.
* Waarom heeft de FDA deze manipulaties en schendingen van het protocol niet aangepakt nadat het bedrijf zijn beoordeling had ingediend?






