Op 1 mei heeft de Amerikaanse Food and Drug Administration (FDA) een ’toestemming voor dringend gebruik’ afgegeven voor de behandeling van ernstige gevallen van COVID-19 met het antivirale remdesivir. En op 25 juni heeft het Europees Geneesmiddelenbureau (EMA) de Europese Commissie de “voorwaardelijke vergunning” voor deze patiënten aanbevolen .
De remdesivir heeft de afgelopen dagen om twee redenen voor controverse gezorgd. Ten eerste zal de marketingprijs iets meer dan € 2.000 per patiënt bedragen , wat een nieuw bio-ethisch maatschappelijk debat op gang heeft gebracht over de verwerving van medicijnen en de volksgezondheid.
Maar daarnaast heeft de Amerikaanse regering de komende drie maanden 90% van de productie van dit medicijn verworven .
Wat is remdesivir en hoe werkt het?
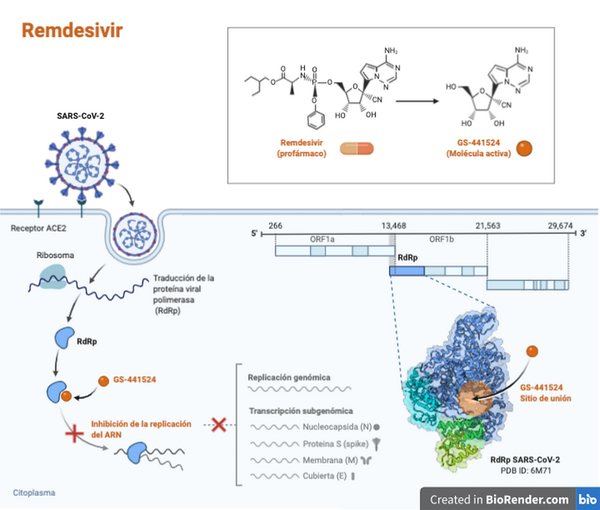
Remdesivir is een antivirale prodrug (een onschadelijke stof die in het lichaam verandert in een medicijn wanneer het wordt gemetaboliseerd). Het behoort tot de familie van nucleotide-analogen en werkt door het remmen van een enzym van het virus dat essentieel is voor de vermenigvuldiging ervan. Er is aangetoond dat het in vitro activiteit heeft tegen SARS-CoV-2:

Remdesivir is ontwikkeld als behandeling voor infectie met het ebolavirus, maar heeft ook in vitro activiteit tegen andere virussen, waaronder enkele coronavirussen zoals MERS en SARS-CoV-2 .
Is het effectief en veilig bij patiënten met COVID-19?
De voorlopige resultaten van een gerandomiseerde, dubbelblinde, gecontroleerde studie uitgevoerd in Hubei, China, werden eind april 2020 gepubliceerd in The Lancet . 237 patiënten (158 behandeld met remdesivir en 79 behandeld met placebo) met ernstige SARS-CoV-2-infectie werden in dit onderzoek geïncludeerd.
De studie evalueerde “tijd tot klinische verbetering”. Hoewel de resultaten niet statistisch significant waren, werd waargenomen dat de “tijd tot klinische verbetering” korter was bij patiënten die remdesivir kregen binnen de eerste 10 dagen vanaf het begin van de symptomen.
Echter, andere studies, zoals de NIAID-ACTT-1 – een andere multinationale, gerandomiseerde, dubbelblinde en gecontroleerde klinische studie – , die de werkzaamheid en veiligheid van remdesivir bij ziekenhuispatiënten met SARS-CoV-2-pneumonie evalueerden wel statistisch significante resultaten behaald.
In dit geval hadden de patiënten die remdesivir kregen een 31% kortere ’tijd tot klinische verbetering’ dan degenen die placebo kregen. Concreet was “de gemiddelde tijd tot klinische verbetering” 11 dagen voor patiënten behandeld met remdesivir, vergeleken met 15 dagen in de groep patiënten die placebo kregen.
De resultaten suggereerden ook een overlevingsvoordeel, met een sterftecijfer van 7,1% in de remdesivir-groep, vergeleken met 11,9% in de placebogroep. Deze verbetering werd vooral waargenomen bij patiënten met respiratoir falen (zuurstoftekort in het bloed), maar die geen mechanische of extracorporale ademhaling nodig hadden.
Wat de verdraagbaarheid betreft, is het veiligheidsprofiel van remdesivir niet volledig gekarakteriseerd. Het grootste deel van de klinische ervaring heeft betrekking op het gebruik ervan bij de bestrijding van ebola , die sterk verschilt van SARS-CoV-2. Tot nu toe zijn er echter geen veiligheidsbevindingen die het gebruik ervan bij patiënten met COVID-19 verhinderen.
Een van de problemen waarmee rekening moet worden gehouden bij patiënten die met remdesivir worden behandeld, zijn de nier- en leverfunctie, die voor en tijdens de behandeling moeten worden gecontroleerd. Gegevens over mededogend gebruik bij 61 ernstige COVID-19-patiënten behandeld met remdesivir, gepubliceerd in het New England Journal of Medicine in april , toonden aan dat de meest voorkomende bijwerking verhoogde leverenzymspiegels waren, waargenomen bij 23% van de patiënten, met hypotensie als tweede (8% van de patiënten).
Aan de andere kant vertoont remdesivir enkele structurele en functionele overeenkomsten met een ander antiviraal geneesmiddel, tenofovir, waarvan is bevestigd dat het nefrotoxisch is , zowel bij patiënten met chronische type B-hepatitis als bij diermodellen. Bij mensen wordt remdesivir grotendeels geëlimineerd op nierniveau, wat een organische ophoping van het geneesmiddel kan veroorzaken bij patiënten met nierfalen.
Gastro-intestinale bijwerkingen van lagere intensiteit, zoals misselijkheid en diarree, zijn ook gemeld bij 3% tot 5% van de behandelde patiënten, hoewel deze effecten ook in verband kunnen worden gebracht met COVID-19-symptomen .
Hoe en wanneer wordt het toegediend?
Remdesivir wordt toegediend via een intraveneuze infuuslijn. Het gebruik is beperkt tot ziekenhuiscentra waar patiënten voor en tijdens de behandeling nauwlettend kunnen worden gevolgd en de lever- en nierfunctie kunnen worden gecontroleerd. De behandeling moet beginnen met een infusie van 200 mg op de eerste dag, gevolgd door een infusie van 100 mg per dag gedurende nog minimaal 4 dagen. Nooit meer dan 10 dagen.
Waarom uw voorwaardelijke toestemming?
De beoordeling van voorlopige kwaliteits-, fabricage-, preklinische en klinische gegevens, evenals veiligheidsgegevens van ervaring die is opgedaan met het gebruik van dit medicijn in compassionate use-programma’s, begon in april 2020. Met al deze gegevens heeft de EMA de voorwaardelijke autorisatie van dit medicijn voorgesteld, wat impliceert dat de werkzaamheids- en veiligheidsgegevens moeten worden uitgebreid, dus het is noodzakelijk om het onderzoek met dit medicijn voort te zetten.
Voorwaardelijke toelating van een geneesmiddel houdt in dat het wordt geacht te voorzien in een onvervulde medische behoefte, in die zin dat het voordeel voor de volksgezondheid dat het onmiddellijk beschikbaar is, groter is dan de onzekerheid die voortvloeit uit de beperking van de beschikbare gegevens.
Het marketinglaboratorium (in dit geval Gilead Sciences) moet zich er echter toe verbinden meer klinische gegevens te verstrekken die de huidige informatie over de werkzaamheid en veiligheid van het geneesmiddel aanvullen. In die zin wordt alleen als deze gegevens positief zijn, volledige en definitieve autorisatie verleend. Anders wordt het uit de handel genomen.
Wat kunnen we verwachten van dit antivirale middel?
Remdesivir heeft een belangrijke deur geopend voor de behandeling van COVID-19. Het is de eerste geautoriseerde agent die rechtstreeks op het virus inwerkt. Maar hoewel de werkzaamheid aanvankelijk is aangetoond bij ernstig of zeer ernstig zieke patiënten, is het veiligheidsprofiel niet volledig opgehelderd.
Momenteel zijn er meer dan zeven klinische onderzoeken ter wereld die dit antivirale middel evalueren, en Johns Hopkins University beschouwt remdesivir als het meest veelbelovende medicijn op dit moment voor de behandeling van COVID-19.
Om al deze redenen moet de wetenschappelijke gemeenschap, samen met de gezondheids- en regelgevende instanties, alle klinische gegevens die de komende maanden zullen worden verstrekt nauwlettend volgen om de geschiktheid van deze behandeling definitief te bevestigen.