
Onderzoekers van de Universiteit van Cambridge hebben AI ingezet om de zoektocht naar nieuwe therapieën voor de ziekte van Parkinson dramatisch te versnellen.
Door machine learning-technieken te gebruiken, konden ze miljoenen potentiële medicijnverbindingen screenen en de meest veelbelovende kandidaten tien keer sneller en duizend keer kosteneffectiever identificeren dan conventionele methoden.
- Onderzoekers van de Universiteit van Cambridge hebben een model getraind om Parkinson-medicijnen te ontdekken
- Het zoekt iteratief naar chemische structuren en voorspelt hun effectiviteit
- Het model is tien keer sneller en duizend keer goedkoper dan conventionele methoden
De ziekte van Parkinson is een complexe, progressieve neurodegeneratieve ziekte waaraan ongeveer 6 miljoen mensen wereldwijd lijden. Verwacht wordt dat dit cijfer tegen 2040 zal verdrievoudigen.
Momenteel zijn er geen behandelingen die de progressie van de ziekte op betrouwbare wijze kunnen vertragen of stoppen.
Het traditionele proces van het screenen van enorme chemische bibliotheken om potentiële kandidaat-geneesmiddelen te vinden is uiterst traag, duur en vaak niet succesvol.
“Eén route om te zoeken naar mogelijke behandelingen voor de ziekte van Parkinson vereist de identificatie van kleine moleculen die de aggregatie van alfa-synucleïne kunnen remmen, een eiwit dat nauw verbonden is met de ziekte”, vertelde hoofdonderzoeker professor Michele Vendruscolo aan de Universiteit van Cambridge.
“Maar dit is een uiterst tijdrovend proces – alleen al het identificeren van een hoofdkandidaat voor verder testen kan maanden of zelfs jaren duren.”
Om deze uitdaging aan te gaan, ontwikkelden Vendruscolo en zijn team een machine learning-aanpak in vijf stappen. De studie werd gepubliceerd in Nature Chemical Biology .
- Begin met een kleine reeks verbindingen, geïdentificeerd via simulaties, die potentieel aantonen om het klonteren van het alfa-synucleïne-eiwit, de belangrijkste oorzaak van Parkinson, te blokkeren. Test vervolgens experimenteel hun effectiviteit.
- Gebruik de resultaten om een machine learning-model te trainen om te voorspellen welke moleculaire structuren en eigenschappen een verbinding effectief maken in het voorkomen van eiwitaggregatie.
- Implementeer het getrainde model om snel een virtuele bibliotheek met miljoenen verbindingen te screenen en de krachtigste kanshebbers te voorspellen.
- Valideer experimenteel de beste AI-geselecteerde kandidaten in het laboratorium. Voer deze resultaten terug in het model om de voorspellingsmogelijkheden verder te verfijnen.
- Herhaal deze cyclus van computationele voorspellingen en experimentele tests, waarbij het AI-model elke ronde slimmer wordt en zich concentreert op de krachtigste verbindingen.
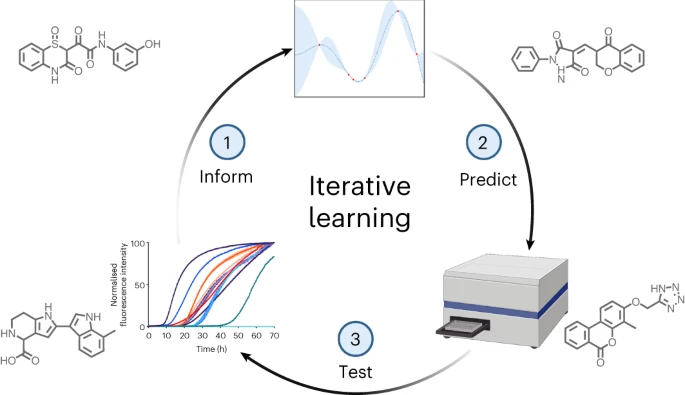
Over meerdere iteraties steeg het optimalisatiepercentage – het percentage geteste verbindingen dat de klontering van alfa-synucleïne geassocieerd met Parkinson remde – van 4% naar meer dan 20%.
Bovendien waren de door de AI gevonden verbindingen gemiddeld veel krachtiger dan alle eerder geïdentificeerde verbindingen. Sommige vertoonden veelbelovende activiteit bij acht keer lagere doses. Ze waren ook chemisch diverser, waarbij het model effectieve verbindingen ontdekte die verschilden van bekende structuren.
“Machine learning heeft een reële impact op de ontdekking van geneesmiddelen – het versnelt het hele proces van het identificeren van de meest veelbelovende kandidaten”, aldus Vendruscolo.
“Door gebruik te maken van de kennis die we hebben opgedaan bij de eerste screening met ons machine learning-model, konden we het model trainen om de specifieke regio’s op deze kleine moleculen te identificeren die verantwoordelijk zijn voor binding. Vervolgens kunnen we opnieuw screenen en krachtigere moleculen vinden.”
“Voor ons betekent dit dat we kunnen gaan werken aan meerdere programma’s voor het ontdekken van geneesmiddelen – in plaats van slechts één. Er is zoveel mogelijk dankzij de enorme reductie in zowel tijd als kosten – het is een spannende tijd.”
De onderzoekers benadrukken dat dit nog maar het begin is van wat AI-first-benaderingen mogelijk zouden kunnen maken bij de ontdekking van geneesmiddelen voor de ziekte van Parkinson en andere ziekten die worden gekenmerkt door verkeerd vouwen en aggregatie van eiwitten.
Met verdere ontwikkeling en grotere trainingsdatasets zou de voorspellende kracht van deze modellen alleen maar moeten verbeteren.
Hoewel er nog een lange weg te gaan is om deze door AI geïdentificeerde kandidaten om te zetten in goedgekeurde behandelingen, laat deze studie zien hoe machine learning, op een slimme manier gecombineerd met experimentele biologie, de vroege stadia van de ontdekking van geneesmiddelen enorm kan versnellen.
Dit bouwt voort op een reeks onderzoeken die de uitdaging aangaan om nieuwe, nieuwe medicijnbehandelingen te vinden, onder meer van MIT en Tufts , dat onlangs een model heeft gebouwd dat dagelijks zo’n 100 miljoen verbindingen kan doorzoeken.
Verschillende modellen voor het ontdekken van antibiotica hebben experimentele verbindingen opgeleverd, waarvan sommige op weg zijn naar klinische proeven .
Een ander grootschalig project in samenwerking met het Moorfields Eye Hospital in Groot-Brittannië van vorig jaar maakte gebruik van oogscans om de vroege tekenen van Parkinson te identificeren – een nieuwe methode die mogelijk wordt gemaakt door AI.
Met deze nieuwe studie, die tot doel heeft effectieve Parkinson-behandelingen te ontdekken, tonen AI-methoden een enorme belofte bij het herdefiniëren van geneeskunde en gezondheidszorg.

Onderzoekers gebruiken AI om verschillende oorzaken van Parkinson te voorspellen
De AI onderzocht beelden van hersencellen en kon veranderingen in belangrijke delen van de cel identificeren die kenmerkend zijn voor de verschillende bekende mechanismen die Parkinson veroorzaken.
Ook wij hebben jou steun nodig in 2025, gun ons een extra bakkie koffie groot of klein.
Dank je en proost?
Wij van Indignatie AI zijn je eeuwig dankbaar
Hoe ontstaat Parkinson?
Parkinson wordt veroorzaakt door het verlies van dopamineproducerende cellen in de hersenen. Hoewel de exacte oorzaak onbekend is, heeft onderzoek gesuggereerd dat Parkinson wordt veroorzaakt door een combinatie van genetica en de omgeving. Maar er zijn veel verschillende routes in het lichaam die de belangrijkste oorzaak van Parkinson kunnen zijn als ze niet werken zoals ze zouden moeten.
Twee van de routes die betrokken zijn bij de ziekte van Parkinson zijn de ophoping van giftige alfa-synucleïne en problemen met energieproducerende mitochondriën, wat betekent dat hersencellen niet genoeg energie krijgen om te overleven.
De leeftijd waarop mensen Parkinson ontwikkelen, de symptomen die mensen ervaren, hoe snel de symptomen zich ontwikkelen en hoe ernstig de symptomen van mensen zijn, het zijn allemaal zaken die per individu verschillen. Sommige onderzoekers suggereren dat dit komt omdat Parkinson veroorzaakt kan worden door problemen in verschillende routes in het lichaam.
Wat is kunstmatige intelligentie?
Kunstmatige intelligentie (AI) is de intelligentie van machines of software, in plaats van de intelligentie van mensen of dieren. Eén manier waarop dit wordt gedaan, is door gegevens en algoritmen te gebruiken om te kopiëren hoe mensen leren. Dit verbetert de nauwkeurigheid van de voorspellingen die het kan maken. Het kan voor veel verschillende dingen worden gebruikt, waaronder om te voorspellen hoe bepaalde aandoeningen worden veroorzaakt.
Korte samenvatting
In een nieuwe studie onderzochten onderzoekers beelden van verschillende hersencellen die zo waren ontworpen dat ze defecten vertoonden in specifieke routes, zoals mitochondriale disfunctie. Lees een samenvatting van het onderzoek in Nature Machine Intelligence . Met behulp van AI konden ze nauwkeurig onderscheiden welke routes defect waren in verschillende cellen. Dit opent de mogelijkheid dat AI in de toekomst kan worden gebruikt om Parkinson te subtyperen, om meer gepersonaliseerde behandelingen te helpen ontwikkelen.
Wat deden de onderzoekers?
Met behulp van stamcellen (cellen waarvan elk type cel kan worden gemaakt, zoals hartcellen, huidcellen en hersencellen), ontwikkelden de onderzoekers hersencellen die vier van de verschillende routes nabootsen die bij Parkinson worden beïnvloed. De verschillende routes die ze nabootsten waren:
- Hersencellen met mutaties in het SNCA-gen, waardoor alfa-synucleïne toxische klonten vormt.
- Alfa-synucleïne dat van hersencel naar hersencel reist, waardoor het aantal cellen dat door alfa-synucleïne wordt beschadigd, toeneemt.
- Hersencellen met defecte mitochondriën, veroorzaakt door een pesticide genaamd rotenon.
- Hersencellen met mutaties in de PINK1- en PARKIN-genen, die problemen veroorzaken bij het opruimen van defecte mitochondriën. De PINK1- en PARKIN-genen worden geassocieerd met de ziekte van Parkinson op jonge leeftijd.
De onderzoekers namen de hersencellen en labelden de verschillende delen van de cel met fluorescerende markers. Ze labelden de mitochondriën, het celcentrum of de celkern en de lysosomen, die afvaleiwitten uit de cel afbreken.
Ze maakten beelden van de hersencellen, inclusief de gelabelde delen van de cellen. De AI keek naar elk van de afbeeldingen, evenals naar afbeeldingen van hersencellen die zonder problemen waren gemanipuleerd. De AI keek naar veel verschillende kenmerken in elk van de hersencellen en gebruikte deze informatie om te zien hoe verschillende delen van de cel met elkaar interageren in cellen met problemen in verschillende routes, en in cellen die geen problemen hadden.
Nadat de AI begreep hoe de cellen werkten, lieten de onderzoekers de softwarebeelden zien die ze nog niet eerder hadden gezien. Dit was om te bepalen of die cellen Parkinson hadden, en zo ja, welke route in de cel was veranderd om Parkinson te veroorzaken.
Wat waren de resultaten?
De AI kon met 95% nauwkeurigheid bepalen of de hersencel normaal was of identificeren welke van de vier veranderde routes bij Parkinson deze tot uitdrukking bracht.
De mitochondriën en de lysosomen waren de meest nuttige kenmerken die de AI hielpen het juiste type pathologie te detecteren. Dit suggereert dat deze veranderingen in deze twee routes mogelijk de belangrijkste oorzaken zijn van de ziekte van Parkinson.
Wat zijn de volgende stappen?
Deze resultaten zijn positief. Maar ze zijn alleen afkomstig van hersencellen die zijn ontwikkeld op basis van stamcellen. De volgende stappen omvatten het testen van de AI op hersencellen van mensen met Parkinson, om te zien of de resultaten kunnen worden gerepliceerd.
De onderzoekers zullen ook kijken naar andere paden die niet goed werken bij mensen met Parkinson, en testen of de AI problemen in meer paden nauwkeurig kan detecteren.
Wat betekenen deze resultaten?
Door te begrijpen welke routes niet correct werken bij mensen met Parkinson, kunnen we deze informatie in de toekomst mogelijk gebruiken om uit te zoeken of mensen verschillende subtypes van Parkinson hebben. We zouden dit vervolgens kunnen gebruiken om meer gepersonaliseerde behandelingen te ontwikkelen en ons op verschillende trajecten te richten bij mensen met verschillende subtypes van Parkinson, zodat behandelingen effectiever kunnen zijn.
In de toekomst zouden medicijntherapieën kunnen worden getest op hersencellen die zijn ontwikkeld op basis van stamcellen om te zien welke routes ze het beste kunnen behandelen. En als ze succesvol zijn in het behandelen van een bepaald traject dat de ziekte van Parkinson veroorzaakt, zouden klinische onderzoeken kunnen beginnen met het werven van mensen, afhankelijk van de trajecten die de belangrijkste aanjagers zijn van hun Parkinson.
Professor David Dexter, onderzoeksdirecteur bij Parkinson’s UK, zei:
“Dit baanbrekende onderzoek heeft het potentieel van AI benut om unieke kenmerken te identificeren in hersencellen die in het laboratorium zijn gekweekt, die kenmerkend zijn voor verschillende oorzaken van Parkinson, zoals mitochondriale disfunctie. Dit vergroot de mogelijkheid dat we op een dag Parkinson kunnen subtyperen en gepersonaliseerde geneesmiddelen om de symptomen te stoppen, te vertragen of om te keren.
“Hoewel dit een belangrijke stap is, moeten onderzoekers nog steeds aantonen of deze technologie op betrouwbare wijze mensen met Parkinson kan subtyperen. Als dat mogelijk is, zou de praktische toepassing ervan in klinische onderzoeken ervoor kunnen zorgen dat er meer nieuwe levensveranderende behandelingen worden ontwikkeld en op de markt komen. Iets wat de 145.000 mensen met de aandoening in Groot-Brittannië willen en verdienen.”







